Een paar weken terug hielden we een kleine experimenteerdag: na heel wat uitstellen gingen we toch eens een bakje droog ijs halen. Voor we je kunnen uitleggen waarom dat al zo lang op onze to-dolijst stond, moeten we echter eerst even de basics bespreken. Te beginnen met: wat is droog ijs en waarom heet het zo? Daarnaast we vertellen je natuurlijk nog heel wat leuke weetjes en tonen we enkele interessante experimenten.
Wat is droog ijs?
In onze blogpost over sublimatie hadden we het al over fasen (vast, vloeibaar en gasvormig) en faseovergangen (smelten, stollen, verdampen, condenseren, sublimeren en rijpen). Daartussen zou je misschien de termen ijs en bevriezen verwachten, maar in het wetenschappelijk jargon komen die eigenlijk niet voor. IJs is namelijk steeds een vaste stof, maar niet elke vaste stof zou je ijs noemen. Een kaars, gietijzeren pan of vulkanisch gesteente bestaan allemaal uit vaste stoffen, maar niemand zegt dat kaarsvet bevriest als het van de kaars afdrupt, dat metaal bevriest wanneer die pan gegoten wordt of dat lava bevriest eenmaal afgekoeld.
IJs is met andere woorden een term die we voor allerhande stoffen in vaste vorm gebruiken, maar die enkel bij sociale conventie gedefinieerd is, en niet op basis van een fysische eigenschap. Veelal gebruiken we de term ijs in de context van stoffen die we ook vaak of zelfs vaker in hun vloeibare of gasvormige fase tegenkomen. Het referentiepunt is natuurlijk waterijs, maar ook bevroren melk, frisdrank, pastasaus, … noemen we al eens ijs.
Waterijs is natuurlijk nat zodra je ermee interageert: zodra je een ijsblokje uit de diepvries haalt, begint dat te smelten en ontstaat er een plasje water. Droog ijs daarentegen, zoals de naam al doet vermoeden, wordt niet nat bij opwarmen. Droog ijs is dus zeker al geen waterijs, maar wat dan wel?
Net zoals nat ijs de vaste vorm van H2O (water) is, is droog ijs de vaste vorm van CO2 (koolstofdioxide). Kan CO2 dan niet smelten? Jawel hoor, er bestaat zeker en vast ook vloeibare CO2 … onder de juiste omstandigheden. Je weet ongetwijfeld dat water smelt bij 0°C en kookt bij 100°C, maar weet je ook dat dit eigenlijk niet het hele verhaal is? Misschien hoorde je al eens zeggen dat water sneller kookt in de bergen. Dit heeft te maken met de lagere luchtdruk op hoge bergtoppen. Ook om het gedrag van CO2 te begrijpen zullen we meer dan enkel de temperatuur moeten bekijken.
Fasediagrammen
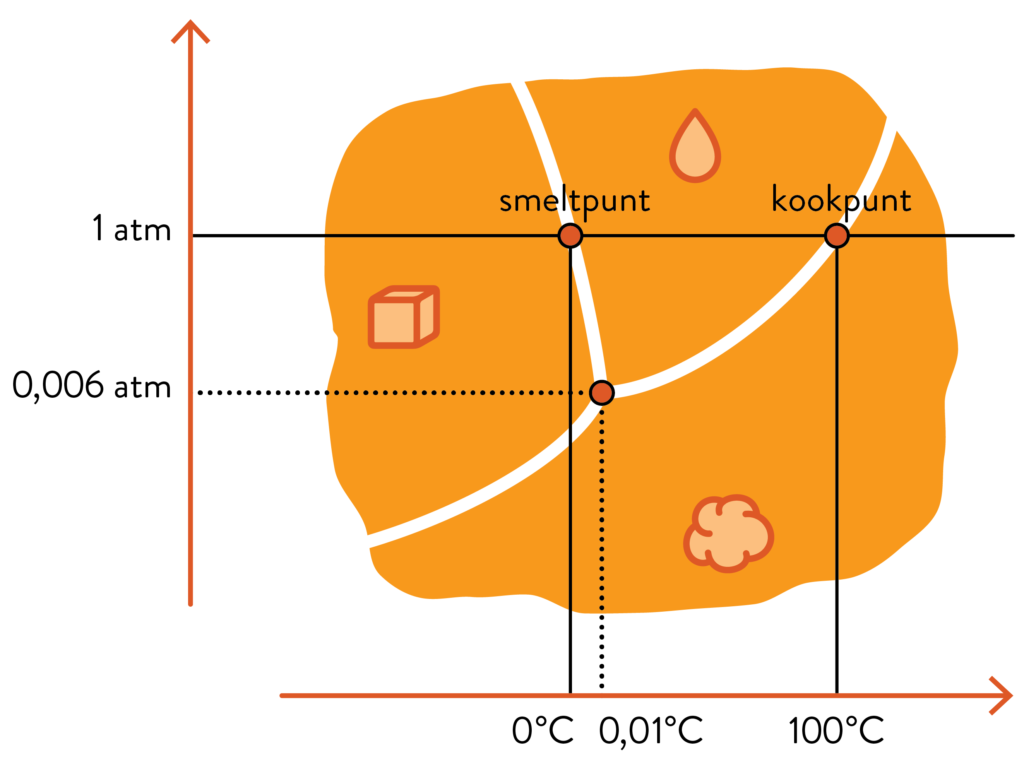
Om het gedrag van een stof onder invloed van temperatuur en druk overzichtelijk weer te geven, gebruiken wetenschappers en ingenieurs zogeheten fasediagrammen. Op de assen worden temperatuur en druk uitgezet en in het diagram wordt het gedrag van de stof onder die omstandigheden benoemd. Merk op: op onderstaande schetsen zijn de assen niet op schaal of gelijklopend voor de verschillende stoffen.
Door de blauwe lijn te volgen op 1 atmosfeer (zo’n 1013,25 hPa), zie je het “gebruikelijke” gedrag van een stof bij normale druk. Zo zie je bij water een overgang van vast naar vloeibaar bij 0°C en een overgang van vloeibaar naar gasvormig bij 100°C, het kookpunt van water. Als je ooit al eens een schaaltje water uit hebt laten staan, dan weet je echter dat water ook van vloeibaar naar gasvormig verdampt bij lagere temperaturen. Zo’n fasediagram bespreekt namelijk een erg specifieke situatie waar enkel verschillende vormen van water aanwezig zijn, en geen “lege ruimte” (lees: waterloze lucht) waar watermoleculen naar kunnen ontsnappen.
De technische details zijn … best technisch, dus hoe zo’n fasediagram exact te interpreteren valt, zou ons te ver leiden. Toch kunnen we door het fasediagram van CO2 te vergelijken met dat van bekendere stoffen zoals water en ethanol, het gedrag van droog ijs beter begrijpen.
Waarom is droog ijs droog?
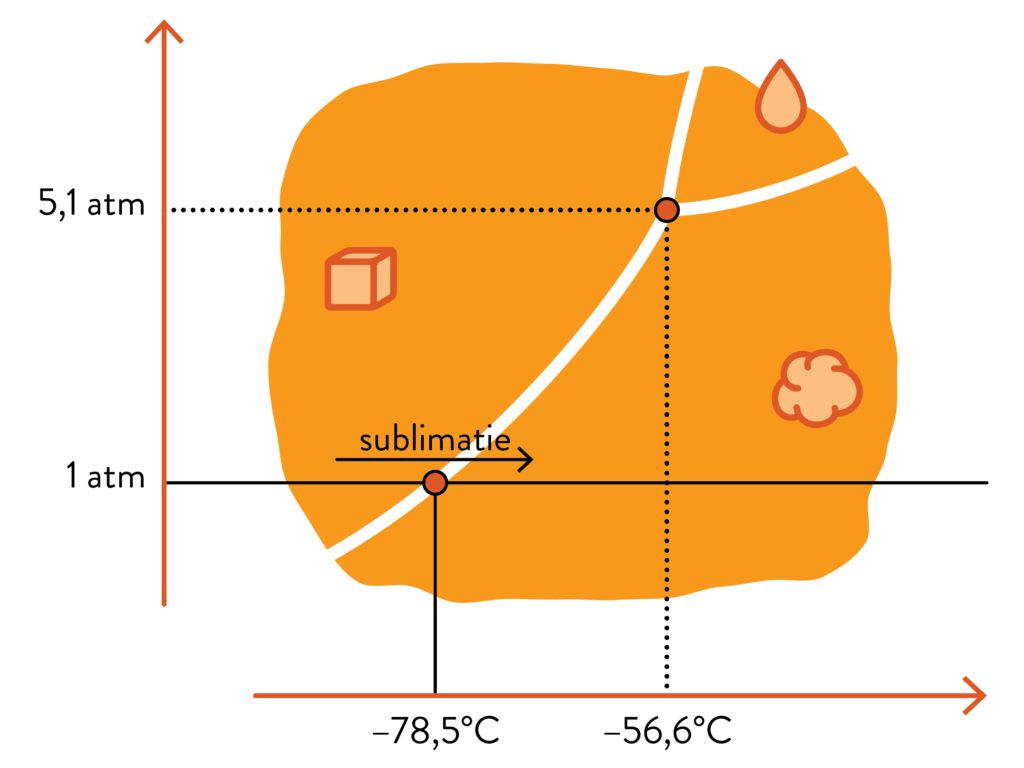
Terug naar onze vraag, waarom smelt droog ijs niet? Als je dezelfde lijn op 1 atmosfeer volgt bij CO2, dan zie je enkel een directe overgang van vast naar gasvormig. Zo’n directe overgang bestaat bij elke stof, maar voor water gebeurt dat bijvoorbeeld bij veel lagere druk. De moleculen hebben in feite zoveel extra energie en ervaren zo weinig tegendruk dat ze meteen de sprong maken van vaste stof naar gas.
Nat CO2-ijs kan in principe dus wel, maar enkel bij een druk vanaf iets meer dan 5 keer de normale luchtdruk. Gezien ijs ook al een term uit de volksmond is, is het dus best redelijk om vaste CO2 ‘droog ijs’ te gaan noemen.
Waarom verschillende stoffen verschillende fasediagrammen hebben, is te danken aan een samenloop van heel veel verschillende eigenschappen van de stof. Zo heeft water een best hoog smelt- en kookpunt dankzij ondermeer de sterke intermoleculaire krachten die de moleculen bijeen houden. Die krachten binnen de stof steken de externe druk een handje toe om de energetische moleculen dichter bij elkaar te houden (met name in een vaste of vloeibare vorm).
Dat gezegd zijnde, vloeibaar water gedraagt zich best bijzonder onder druk. Terwijl de vaste vorm van de meeste stoffen minder ruimte inneemt dan de vloeibare vorm, zet water net uit bij het bevriezen, door de inefficiënte kristalstructuur die water aanneemt. (Wikipedia lijst maar liefst 23 verschillende types waterijs op, dus het is opnieuw wel wat ingewikkelder dan dat, maar dat is een verhaal voor een andere keer.)
Leuke experimentjes voor thuis
Waarom zou je zo’n bakje droog ijs misschien wel in huis willen halen (of eens op onze workshop met droog ijs willen experimenteren)? Wel, droog ijs heeft drie leuke eigenschappen die tot heel wat coole experimenten leiden.
Droog ijs is koud
Dat ijs koud is, verbaast je wellicht niet. Droog ijs is echter heel wat kouder dan gewoon nat (water)ijs. In de fasediagrammen hierboven was dat je misschien al opgevallen: daar zie je dat droog ijs sublimeert of rijpt bij –78,5°C onder 1 atmosfeer aan druk. Als je dus droog ijs ziet, dan heeft het minstens zo koud. In praktijk is het droog ijs dat je koopt echter nog kouder, onder meer omdat dat het gebruiksvriendelijker maakt. Je kan het vergelijken met je diepvries die tot ongeveer –18°C koelt, ook al bevriest water al bij 0°C — zou je diepvries een temperatuur van precies 0°C nastreven, dan zouden je ijsblokjes maar heel traag bevriezen, en heel snel weer smelten eens je ze uithaalt.
Droog ijs is met andere woorden zó koud dat droog ijs een quasi-instant diepvries vormt. Heel wat potentieel voor bijvoorbeeld roomijs, instant koude drankjes, zeepbellen bevriezen, fruit bevriezen zonder oxidatie, …



Droog ijs zet (snel) uit tot een gigantisch volume CO2-gas
Gewoon een blokje droog ijs in water gooien wist ons langer te entertainen dan we durven toegeven. Het is gewoon tof om te zien (en te horen), ook al wisten we op voorhand wat te verwachten en hadden we het proevetje ooit wel eens in de chemieles gezien. Je kan natuurlijk allerhande variaties uittesten door er kleurstof, kokend water, zeepsop, … aan toe te voegen. Zo je wil kan je er zelfs een soort tijdelijke lavalamp mee maken.


Met al die lucht kun je ook ballonnen opblazen (of flesjes doen ontploffen, maar dat doe je natuurlijk wel beter buiten). En heb je al eens geluisterd naar een zingende lepel? Eens je een blokje droog ijs op een warmere ondergrond legt, gaat de onderkant van dat blokje erg snel sublimeren. Daardoor ontstaan onderaan allemaal kleine luchtkussentjes die ontsnappen door het ijsblokje steeds omhoog te duwen. Dat erg snelle op en neer gaan van het ijsblokje (een trilling) horen wij als een zoemend geluidje.
Droog ijs bestaat uit CO2
Opnieuw evident, dat heb ik je net in het lang en het breed uitgelegd! Maar CO2 heeft ook enkele bijzondere eigenschappen die je kan demonstreren met droog ijs.
Je hoorde misschien al eens van een CO2-brandblusser. Zo’n brandblusser werkt omdat een vuur zuurstof nodig heeft om te blijven branden, en je een vuur dus kan doven door er genoeg CO2 op te richten, zodat er geen zuurstof meer overblijft. Een CO2-blusser bevat vloeibare CO2 onder hogere druk, maar je kan hetzelfde effect demonstreren met droog ijs. Omdat CO2 zwaarder is dan lucht, kan je een kaarsje doven door er de CO2 uit je bubbelend bekertje over uit te gieten.
Een tweede eigenschap heb je ongetwijfeld zelf al eens vastgesteld als je een glas spuitwater te lang hebt laten staan. Ook al is de bruis eruit, het smaakt toch niet hetzelfde als gewoon water. Men voegt niet gewoon een smaakje toe aan spuitwater natuurlijk, dus wat is hier aan de hand? Spuitwater wordt gemaakt door onder hogere druk CO2 toe te voegen aan water. Door de extra druk lost de CO2 extra goed op in het water. Zodra je thuis echter de fles opent, daalt de druk terug naar de normale 1 atmosfeer en bubbelt de CO2 op uit het water: een eenvoudig fysisch proces. Een klein aandeel CO2 is echter “extra enthousiast” en gaat chemisch met het water reageren. Die reactie creëert een zwak zuur H2CO3 (koolzuur), dat plat spuitwater z’n bekende, ietwat zure smaak geeft.
Zowel dit chemische als dit fysische proces, komt telkens voor wanneer CO2 en water voorhanden zijn. Water reageert dus ook met de CO2 die overal in de lucht hangt. Beide processen streven echter naar een evenwicht waar afhankelijk van de beschikbare hoeveelheid CO2 en de druk meer of minder CO2 in het water kan oplossen en met het water kan reageren. Onder normale omstandigheden is dit heel weinig, waardoor je kraantjeswater niet bubbelt en niet zuur smaakt, maar een flesje spuitwater volgepompt met CO2 wel. Beide processen nemen echter plaats met een andere snelheid, waar het opgeloste gas erg snel opborrelt, blijft de zure smaak wel langer hangen. Na verloop van tijd zal ook dat restje CO₂ toch uit je spuitwater ontsnappen.
Je kan zelf spuitwater maken door een stukje droog ijs in een glas water te doen, maar gezien de CO2 daar makkelijk uit kan ontsnappen zal je eerder plat geworden spuitwater proeven. Als je een (bijna) gesloten flesje neemt, zal meer CO2 in het water oplossen. Let alleen op dat je geen te hoge druk creëert, want dan kan je flesje wel eens ontploffen!
Wat is die rook?
CO2-gas zelf is kleurloos, dus waarom zie je dan een soort rook wanneer je met droog ijs gaat experimenteren? Wel, droog ijs is zó koud dat het ontstane gas nog altijd koud genoeg is om waterdamp uit de lucht errond te doen condenseren. Zo gaat er zich een mist vormen. Je kan met droog ijs dus je eigen wolkjes maken.
Gezien CO2 zwaarder is dan lucht én koudere lucht zwaarder dan warme, gaan deze wolkjes wel steeds naar beneden dwarrelen. Althans, tot ze voldoende opwarmen, de waterdamp terug verdampt en de wolkjes zich terug onder de omgevende lucht gaan mengen. Hetzelfde proces is trouwens aan de gang wanneer je een stukje droog ijs laat liggen en achteraf toch een klein plasje ziet: afhankelijk van de luchtvochtigheid kan er best wat water op en rond je droog ijs condenseren of rijpen.
Is droog ijs gevaarlijk?
Met een goedje dat een temperatuur van hoogstens –78,5°C heeft, moet je natuurlijk opletten. Als gewoon waterijs op je huid plaatsen al vrieswonden kan veroorzaken, is dat met droog ijs zeker een gevaar zonder de juiste voorzorgsmaatregelen. Daarom krijg je bij het verzorgen van een kwetsuur drie opties: ofwel wikkel je een handdoek om je icepack, ofwel zorg je dat het ijsblokje nooit lang op dezelfde plek blijft door het voortdurend te bewegen, ofwel maak je een water-ijsmengsel (want dat water wordt nooit kouder dan 0°C).
Ruwweg dezelfde opties zijn er voor droog ijs. Een brokje droog ijs dat even langs je hand glijdt, zal je niet met vrieswonden opzadelen en een bekertje water waar je droog ijs in doet, zal ook niet te koud zijn om vast te houden zolang je vloeibaar water ziet. Echter, waar je dat waterijsblokje al eens een minuutje kan laten liggen, heb je bij droog ijs helemaal niet zo’n foutenmarge. Een goed paar isolerende handschoenen of (oven)wanten is dus toch wel een must, of je kan natuurlijk altijd lepels en andere keukeninstrumenten gebruiken i.p.v. je handen.
CO2 is ook niet giftig: het is altijd aanwezig in de lucht rondom ons, je ademt het goedje elke dag in en uit en planten leven ervan. Toch kan droog ijs tot verstikking leiden. De lucht om je heen bevat gemiddeld slechts zo’n 0,04% CO2 — 30% meer dan amper een eeuw geleden, met alle gevolgen van dien, maar in absolute termen nog altijd erg weinig — maar als je daar plots heel wat CO2 aan toevoegt door droog ijs te laten sublimeren, dan kan dat percentage gevaarlijk hoog oplopen. Een volume droog ijs zet namelijk uit tot meer dan 800 keer dat volume aan CO2-gas. Dat kan het percentage zuurstof in de lucht heel wat doen dalen, zodat je longen te weinig onmisbare zuurstof opnemen.
Dat gevaar is makkelijk te vermijden door te werken in een goed verluchte ruimte en naar te buiten gaan bij symptomen zoals hoofdpijn of duizeligheid. In tegenstelling tot koolstofmonoxide of CO zijn deze symptomen tijdelijk en makkelijk te verhelpen. CO bindt namelijk sterker aan het eiwit hemoglobine (dat zuurstof en koolstofdioxide vervoert in ons bloed) dan zuurstof. Dat maakt CO-vergiftiging zo gevaarlijk. CO2 daarentegen is een natuurlijk bijproduct van vele processen in ons lichaam, en onze longen kunnen CO2 dan ook vlotjes uit het bloed halen … zolang er voldoende zuurstof ter vervanging is. Ongevaarlijk dus, zolang je een beetje voorzichtig bent.
Als je aandachtig gelezen hebt, dan is het je misschien opgevallen dat we één experiment subtiel onbesproken lieten … We vertellen je graag de echte reden voor ons enthousiasme over een doos extra koude ijsblokjes, maar deze blogpost is nu al erg lang, dus: wordt vervolgd!